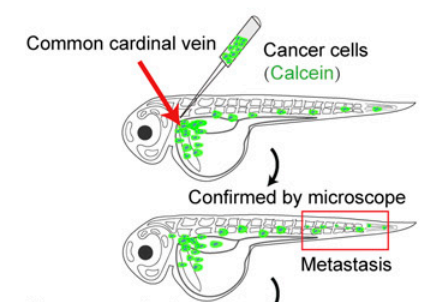
斑马鱼肿瘤移植模型
服务介绍
通过构建肿瘤移植斑马鱼模型,能够可靠的重现多种病人来源的肿瘤生长,转移和凋亡情况。斑马鱼通体透明的特点决定该模型能方便使用荧光标记进行肿瘤研究。通过将斑马鱼模型用于临床前治疗效果的检测,能够快速进行肿瘤体内分析实验,为肿瘤病人的个性化治疗奠定基础。
肿瘤细胞体内增殖情况流程图
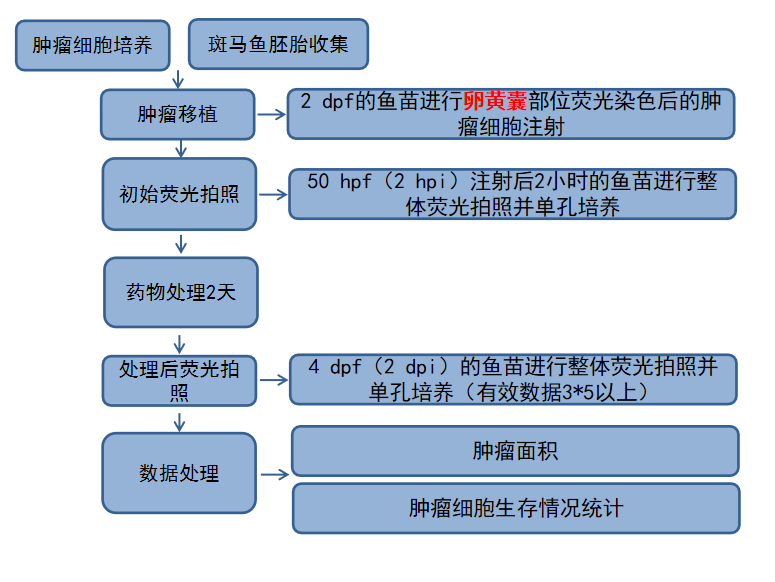
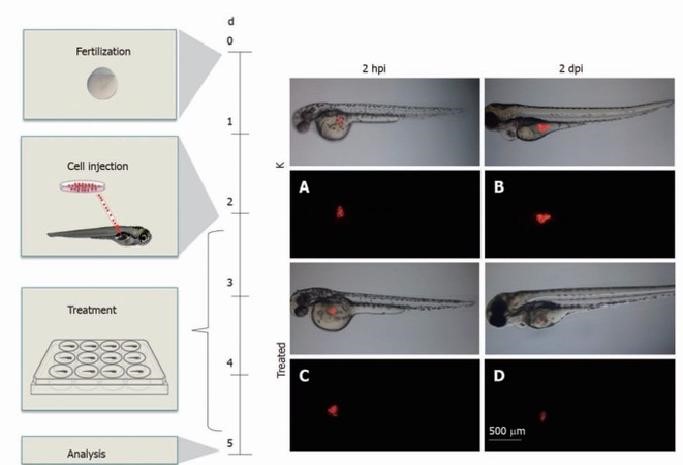
肿瘤细胞体内药效分析转移流程图
斑马鱼肿瘤异种移植优势
斑马鱼作为移植接受者,具有许多固有的特征使它成为理想的移植接受者。
1. 通过荧光标记移植细胞,可以很容易地追踪移植的正常或恶性细胞,并且使用光学透明的斑马鱼品系作为受体,可以直接观察移植情况。
2. 斑马鱼高度多产,成熟的雌性每周能产生数以百计的卵且很小,成千上万的斑马鱼可以保存在一个容器里,管理和维护成本相对较低于大、小鼠。当斑马鱼模型与大规模遗传筛选和药物发现平台相结合时,这些研究为肿瘤内克隆、进化和异质性、治疗耐药、侵袭和转移、造血和干细胞移植提供了有价值的见解。
技术流程
肿瘤细胞体内增殖技术流程
应用案例:
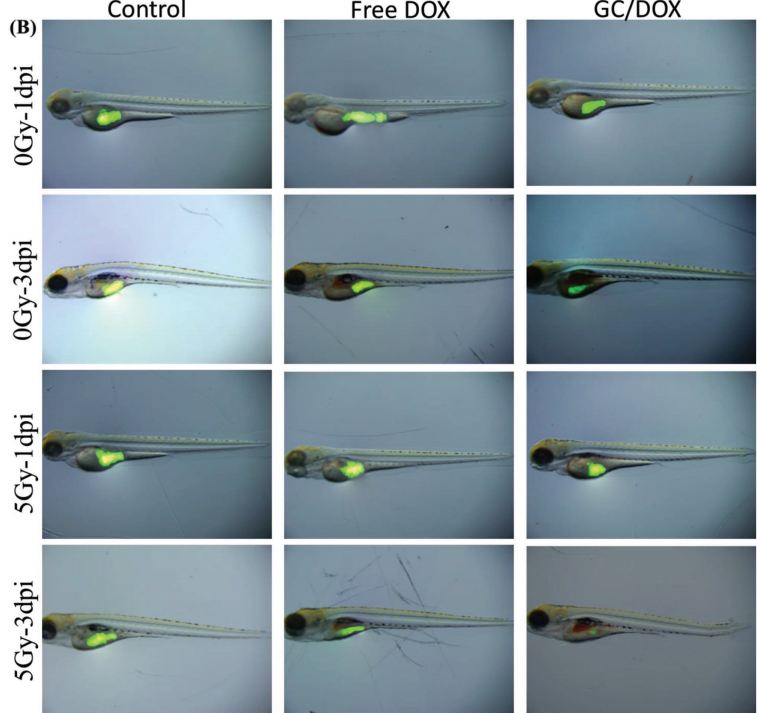
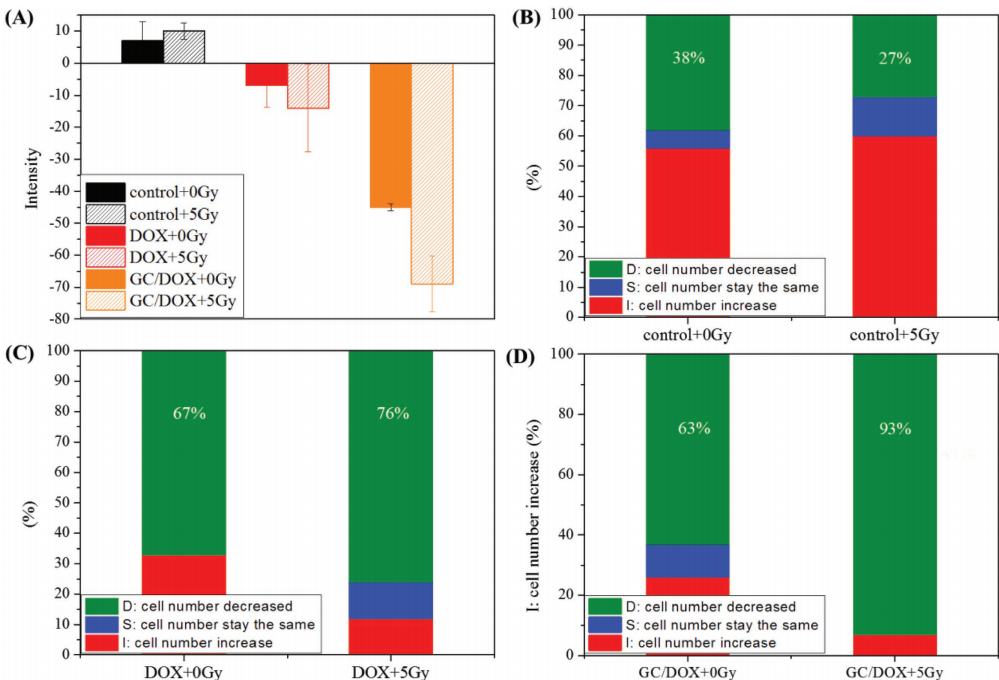
1. 利用斑马鱼人源肿瘤移植模型,进行不同放化疗方案抗肿瘤效果分析,通过分析移植后1dpi和3dpi的荧光情况,得到CG/DOX+5Gy组对肿瘤杀伤显著高于其他组,实验周期不到1周。
备注:与对照组相比,CFSE荧光>5%、0-5%和荧光降低分别导致HeLa细胞数量增加、不变和减少。
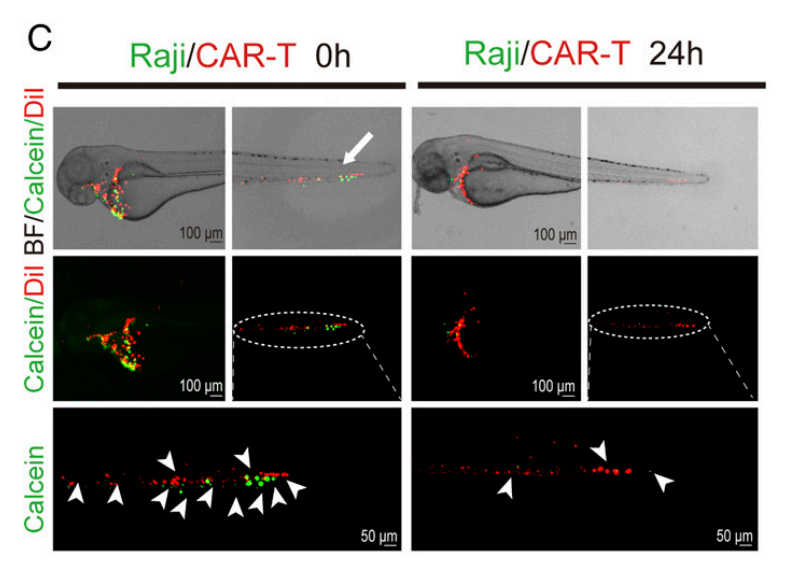
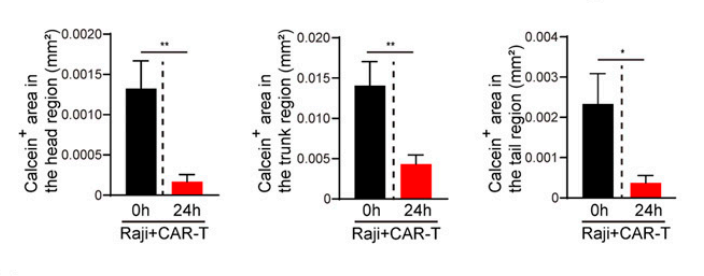
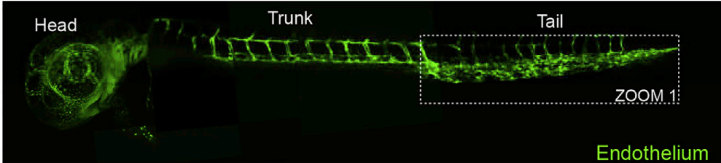
2. 分析CAR-T对Raji细胞的转移灶杀伤效果,通过卵黄囊间隙显微注射,构建人源肿瘤移植模型,实验组同时注射CAR-T细胞,注射后24h,分析斑马鱼头部、躯干和尾部的肿瘤荧光面积,可见对转移到析斑马鱼头部、躯干和尾部的Raji细胞杀伤效果显著。
参考文献:
1. Wu SY,
Chou HY, Yuh CH, Mekuria SL, Kao YC, Tsai HC. Radiation-Sensitive
Dendrimer-Based Drug Delivery System. Adv Sci (Weinh). 2017 Dec 5;5(2):1700339.(IF=15.84)
2. He X,
Yin X, Wu J, Wickström SL, Duo Y, Du Q, Qin S, Yao S, Jing X, Hosaka K, Wu J,
Jensen LD, Lundqvist A, Salter AI, Bräutigam L, Tao W, Chen Y, Kiessling R, Cao
Y. Visualization of human T lymphocyte-mediated eradication of cancer cells in
vivo. Proc Natl Acad Sci U S A. 2020 Sep 15;117(37):22910-22919. (IF=9.412)
常见问题
1. 斑马鱼胚胎显微注射实验操作方法
斑马鱼显微注射是将实验材料直接注射到1-4细胞期的斑马鱼胚胎中,由于在这个胚胎发育早期没有膜分隔细胞和卵黄,注入1个细胞或卵黄的溶液将扩散到整个胚胎中。通过注射不同类型的实验样品,实现基因的瞬时过表达、敲降、以及制备转基因或突变斑马鱼品系等研究。
2. 显微注射的注意事项
显微注射的操作过程中有许多细节影响实验的成功率,主要包括以下几方面。
1) 注射样品的质量和和浓度,注射剂量1nl/embryo。
2) 注射前小心将显微注射针定位,注射针定位到卵表面的注射角度是穿透坚硬的卵壳注射成功的关键。
3) 破针时,将针尖一点点剪断,不宜一次剪太多。
4) 注射时注射器的压力不宜变化太快,否则会造成注射量操作难以控制,导致胚胎内环境改变过快过大甚至胀破细胞。氮气罐的压力阀显示气体的压力,压力为0表明罐内无气体,需要及时换气。
5) 注射完毕,慢慢抽出注射针,避免受精卵内物质随着毛细针抽出,造成受精卵的损伤。
6) 注射后的胚胎需要细心照顾,控制温度、水质和养殖密度。