类器官基因编辑科研服务
项目介绍
体外培养为基因编辑应用提供了高通量的实验可能性,并且更容易操作。重要的是,基因编辑能够进行可操控的设置:通过调节培养基组分中的信号分子来引入和选择精确的突变。基因编辑细胞的体外培养,能够筛选出所需突变的克隆,并将其扩增为细胞系,这在动物模型中是不可能实现的。
服务流程
文献案例
1.
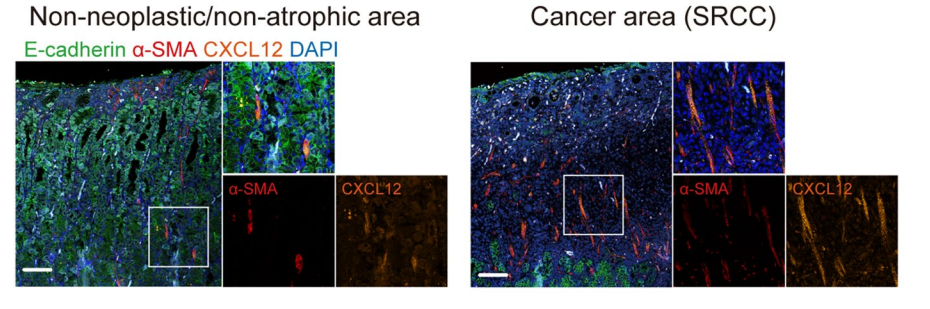
2022年6月Gastric Cancer上发表,利用基本编辑技术,敲除了正常胃癌类器官的CDH1基因,构建了e-钙粘蛋白敏感的人胃类器官模型,发现敲除后的肿瘤类器官与SRCC的细胞形态和细胞活力类似。
2.
2020年3月,Nature Cell
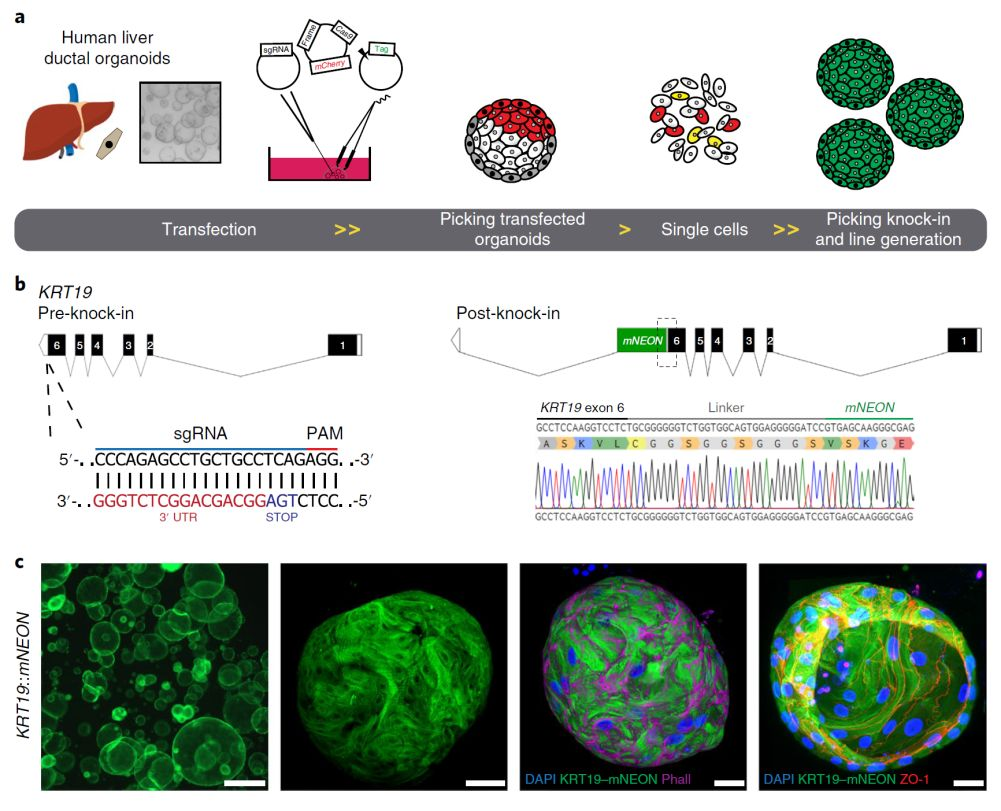
Biology杂志上发表文章,利用非同源依赖的CRISR-Cas9技术快速高效地对人源类器官进行基因敲入(CRISPR–HOT),为人源类器官的内源基因敲入提供了重要的工具平台。通过让癌基因TP53失去功能,发现异常肝细胞的非结构化分裂更为频繁。使用CRISPR-HOT将荧光标记插入人类类器官的DNA中,建立了人肝脏导管类器官的报告基因品系,可以利用活体成像、切片染色等方式可视化观察内源表达的基因表达模式以及动态变化过程。
参考文献:
[1]Yamaguchi K , Yoshihiro T , Ariyama H ,et
al.Potential therapeutic targets discovery by transcriptome analysis of an in
vitro human gastric signet ring carcinoma model[J].Gastric Cancer, 2022,
25(5):862-878.
[2]Artegiani B, Hendriks D, Beumer J, et al. Fast and
efficient generation of knock-in human organoids using homology-independent
CRISPR-Cas9 precision genome editing. Nat Cell Biol. 2020;22(3):321-331.
常见问题
1.
类器官的形态在培养过程中发生变化的原因有哪些?
在常规的培养条件下,形态应当保持一致。
培养物形态变化可能反映出培养条件的问题:
ECM:确保使用了特定模型的ECM,并且稀释至正确的终浓度。
培养基:确保使用正确的培养基配方,且保存条件适当。确保缓冲液更换频率和体积正常。培养密度:多次传代或放大培养规模时,类器官的密度要保持一致。
传代频率:按照一致的传代时间表来维持类器官。